안녕하세요
박셀바이오의 진행성 간암 치료제가 식품의약품안전처로부터 치료목적 사용승인을 받았는데 기존 임상 기준에 포함되지 않은 환자들에게도 치료 기회를 제공할 수 있게 됐다는 설명으로 상업화 가능성을 의미하고 있습니다.
항암면역치료제 개발 전문기업 박셀바이오의 진행성 간암 치료제 ‘Vax-NK/HCC’가 진행성 간암 환자를 대상으로 지난 13일 ‘치료목적 사용승인’을 받았습니다.
치료목적 사용승인 제도는 생명이 위태로울 수 있는 중대한 상황이나 대체치료수단이 없다고 판단하는 경우 등에 놓인 환자에게 치료제의 품목허가를 받기 전 사용할 수 있도록 허가하는 제도로 통상 응급임상 제도로 알려져 있습니다.
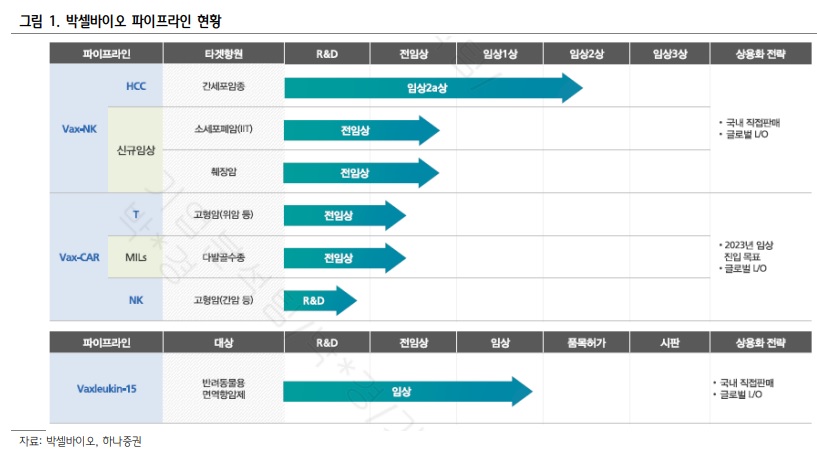
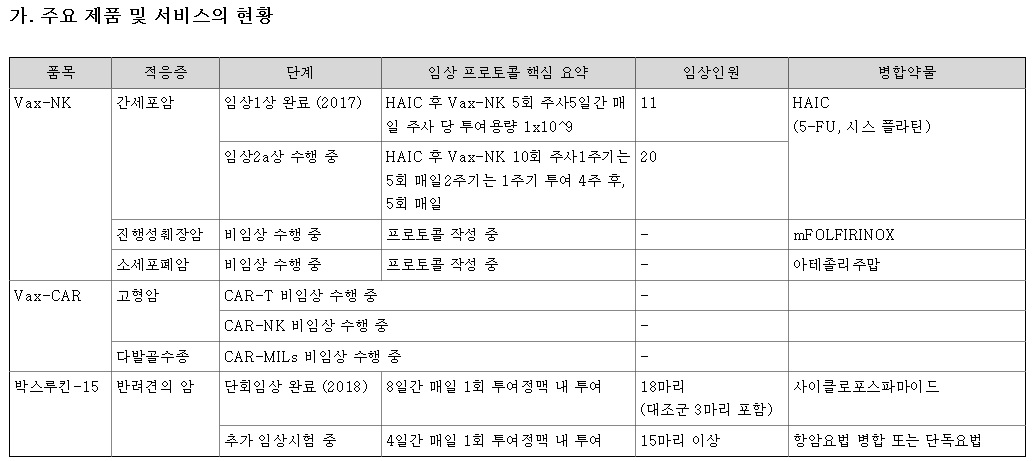
박셀바이오가 임상 2a상연구를 진행중인 Vax-NK/HCC는 진행성 간암을 적응증으로 하는 자가유래 방식의 환자 맞춤형 세포치료제로 안전성과 효능을 임상을 통해 검증받았습니다.
박셀바이오는 현재까지 지방육종, 교모세포종 등 총 9개의 암종을 대상으로 11건의 치료목적 사용승인을 받아 시행해왔는데 간암의 경우 2019년 한차례 치료를 진행한 사례가 있습니다.
당시 기존의 전신항암제 치료에 실패하고 다발성 폐전이가 악화되고 있어 장기 생존을 기대하기 어려웠던 간암 말기 환자가 응급임상을 진행한 후 완전관해(CR) 판정을 받았으며 현재까지 3년 넘게 생존 중에 있어 기적의 항암치료제로 불리기도 합니다.
이제중 박셀바이오 대표는 “치료목적 사용승인 제도를 통해 더 많은 말기암 환자에게 치료기회를 제공하겠다”고 말해 본격적인 상업화 단계를 거치기 위해서는 임상 3상을 완료해야 합니다.
간암치료제 시장이 아직은 그리 크지 않아서 희귀의약품 정도의 시장성을 갖고 있지만 점차 의사들의 치료제 선택이 증가하고 해외에서도 치료제로 선택되는 규모를 늘려갈 경우 박셀바이오를 대표하는 의약품으로 성장할 수 있을 것 같습니다
이번 진행성 간암 치료제가 식품의약품안전처의 조건부 사용승인을 받으면서 주가가 급등하고 있어 이를 빌미로 유상증자에 나설 수 있기 때문에 기존 주주들은 주의할 필요가 있는데 주가가 급등한 이후 유상증자하는 것은 주당가치 희석이 적지만 장기간 주가를 흘러내리게 할 수 있는 악재가 될 수 있습니다
박셀바이오의 NK세포치려제인 진행성간암치료제는 블록버스터급신약이라기 보다는 희귀의약품에 더 가깝기 때문입니다
투자에 참고하세요






'주식시장이야기' 카테고리의 다른 글
| 미국증시 양호한 기업실적발표에 장 막판 반등 성공 (0) | 2023.04.18 |
|---|---|
| 휴비츠 지난 해 사상 최대 실적 달성 올해도 중국시장 성장 수혜 (0) | 2023.04.17 |
| 포스코그룹주 철강 가격 상승과 2차전지 소재 사업 호황에 동반 강세 (0) | 2023.04.17 |
| 윤석열 한반도 평화 외면 남북긴장 고조에 중국과 러시아와도 긴장 고조 코리아디스카운트 확대 (0) | 2023.04.17 |
| 미국증시 기업실적발표로 실적장세 돌입 하락 마감 (0) | 2023.04.17 |