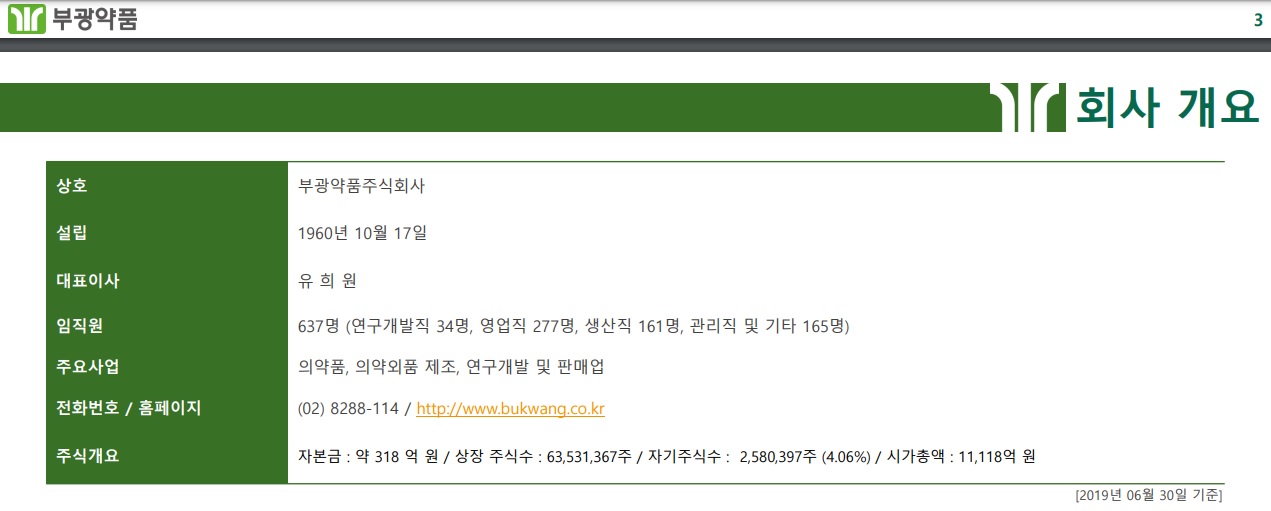
안녕하세요
부광약품은 조현병 및 양극성 우울증 치료제 ‘루라시돈’의 3상 임상시험 탑라인 결과가 성공적이었다고 22일 밝혔습니다.
루라시돈은 스미토모 파마에 의해 개발된 비정형 조현병 및 양극성 우울증 치료제로 부광약품이 한국 독점 개발판권을 확보하고 있습니다.
일차평가변수는 기존 의약품 대비 비열등성을 평가하기 위해 양성 및 음성증후군 척도 (PANSS) total 점수의 변화량을 확인했는데 국내 판매중인 비정형 조현병 치료제인 쿠에티아핀(Quetiapine)과 비교했을 때 결과에서 목표대로 비열등성에 대한 통계적 유의성을 확인 할 수 있습니다.
부광약품은 임상 결과를 기반으로 임상시험 성적서를 작성해 올해 4분기에 신약허가 서류를 식품의약품안전처에 제출할 예정입니다.
이번 임상 시험은 보라매병원을 비롯한 35개 병원에서 210명의 급성 정신병적 증상을 보이는 조현병 환자를 등록해 진행한 무작위 배정, 이중눈가림 임상시험으로 임상 시험의 목적은 기존 비정형 조현병 약물에 대해서 비열등성을 평가하기 위한 것입니다.
루라시돈은 도파민 D2, 세로토닌 5-HT2A및 세로토닌 5-HT7수용체를 차단하는 길항제로 작용하고 또한 세로토닌 5-HT1A수용체에 부분적으로 작용하며 히스타민 H1, 무스카린 M1수용체에 대해서는 거의 친화력을 보이지 않습니다.
한편 루라시돈은 미국에서 성인과 13~17세 청소년의 조현병 치료와 성인과 10~17세 소아의 제1형 양극성 장애(양극성 우울증)의 우울삽화에 대한 단일요법 및 성인에게서 리튬 및 발프로산의 부가요법으로 허가를 받았습니다.
캐나다에서는 성인과 청소년의 조현병 치료와 성인에게서 제1형 양극성 장애의 우울삽화에 대한 단일요법 및 리튬 및 발프로산의 부가요법과 청소년의 제1형 양극성 장애와 관련된 우울삽화의 급성치료에 대한 단일요법으로 허가를 받았습니다.
이밖에도 유럽연합, 영국, 스위스, 러시아, 일본, 중국, 싱가포르, 태국, 홍콩, 대만, 호주, 아랍에미리트(UAE), 쿠웨이트, 사우디 아라비아 및 브라질 등 45개 이상 국가에서 정신분열증에 대한 허가를 취득했으며, 북미시장에서 2조6000억원의 매출을 달성한 블록버스터급 치료제 입니다.
부광약품 관계자는 “루라시돈은 연매출 수백억원이 가능한 대형제품으로 중추신경계(CNS) 제품군의 포트폴리오 강화와 더불어 매출 도약을 위해 더욱 노력을 기울일 계획”이라고 밝혔습니다.
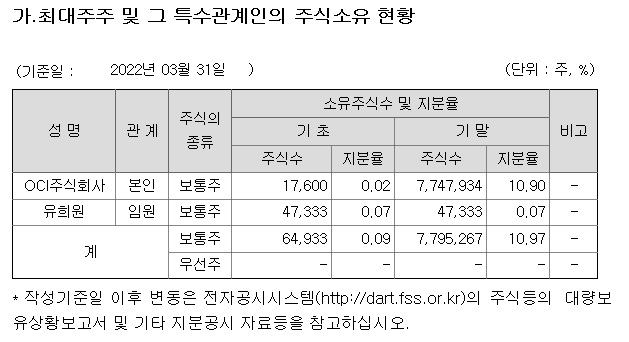
부광약품 경영권이 OCI로 넘어가고 첫번째 연구성과라 의미가 있어 보이는데 부광약품은 이번 OCI의 공동경영 참여를 통해 전략적 투자(SI) 규모를 늘려나가고 파이프라인의 확대를 진행해 성장을 가속화해 나갈 것으로 기대하고 있습니다.
투자에 참고하세요



'주식시장이야기' 카테고리의 다른 글
| 국립중앙박물관 ‘메소포타미아, 저 기록의 땅’ 전시회 개최 메소포타미아 실물 유물 전시 (0) | 2022.07.27 |
|---|---|
| 제지주 국제펄프가격 1000달러 돌파 소식에 동반 강세 (0) | 2022.07.26 |
| '용산 정비창' 일대 약 50만㎡ 부지 본격 개발 용산 대통령실 변수 우려 (0) | 2022.07.26 |
| 검찰 우리은행과 신한은행 통해 이뤄진 2조원대 해외 송금 사건 수사 착수 (0) | 2022.07.26 |
| 이노시스 보통주 1주당 신주 4주 배정 무상증자 결정 (0) | 2022.07.25 |













