안녕하세요
미국 식품의약국(FDA)는 23일(현지시간) 미국의 전자담배 브랜드 '쥴(JUUL)'에 대해 판매금지 결정을 내렸습니다.
로이터 통신등에 따르면 FDA는 이날 쥴의 전자담배에 대해 2년여간 조사를 벌였지만 이 회사 제품이 공중 보건에 적합하다는 점을 입중할 충분한 증거를 제시하는데 부족했다면서 이같이 밝혔습니다.
FDA는 액상형 니코틴이 든 전자담배 카트리지에서 유해 물질이 나올 가능성 등 여러 우려가 제기됐으며 줄 전자담배가 청소년 흡연 증가도 부추겼다고 지적했습니다.
쥴은 이에대해 "우리는 FDA의 판단에 동의하지 않는다"라면서 "FDA의 규제와 법률 하에 우리가 (시장에) 남기 위한 모든 옵션들을 검토할 것"이라고 주장했습니다.
액상형 전자담배인 쥴은 최근 수년간 미국에서 큰 인기를 끌었는데 특히 과일향 등을 가미한 제품들을 시장에 내놓으면서 판매를 확대, 미국 시장 점유율 1위를 기록하기도 했습니다.
이 과정에서 미국 청소년들의 전자담배 흡연률도 급증했는데 FDA 등 미국 보건당국은 쥴을 비롯한 전자 담배들이 청소년 흡연 증가를 부추겼다며 조사에 나섰습니다.
FDA는 지난 2020년 미국 청소년에게 인기를 끌던 과일향 전자담배 판매를 금지하는 한편 전자담배 주요 제조 업체에 대해 제품들이 공공보건에 미칠 긍정적 효과 등에 대한 입증할 자료를 제출하라고 지시했습니다.
쥴과 경쟁 브랜드인 '뷰즈' 등은 자료 분석 결과 독성이 일반 담배에 비해 낮은 것으로 나타나 FDA의 별도 제재를 피했는데 그러나 쥴은 FDA의 기준을 충족하는 데 실패하며 판매금지라는 철퇴를 맞게 됐습니다.
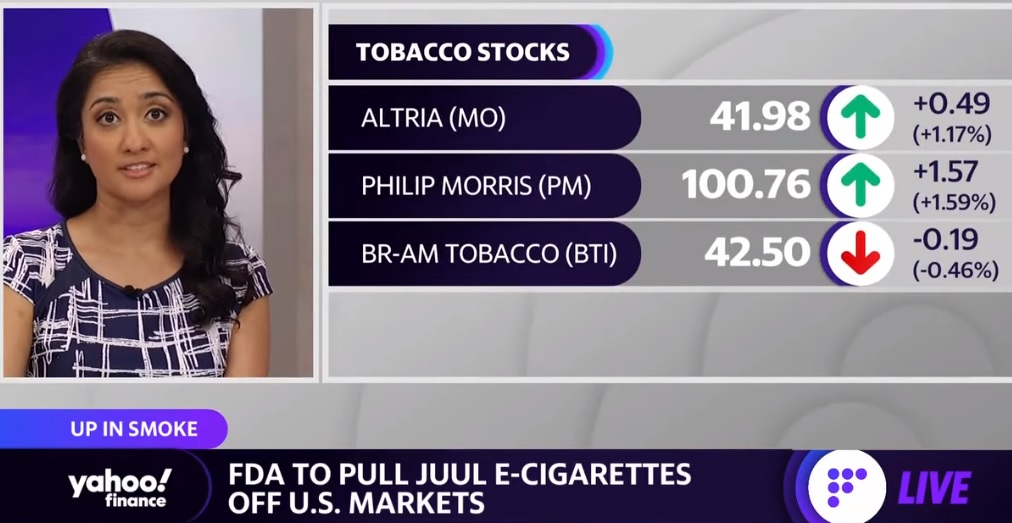
FDA의 판매금지 결정은 쥴랩스에 큰 타격이 될 것으로 전망되는데 시장조사기관 닐슨에 따르면 올 3~6월 쥴은 경쟁사인 뷰즈에 시장점유율 1위를 내줬고 실적도 나빠졌는데 지난해 쥴은 2억5900만달러의 손실을 기록했고 알트리아는 3월 쥴 투자금액의 90%를 상각했습니다
알트리아는 식품과 담배관련 지주회사로 계열사로 필립모리스를 갖고 있고 JUUL도 여기서 생산하고 있습니다
전자담배를 통해 담배회사들은 기성세대의 금연열풍에 줄어든 연초인들을 청소년과 여성에서 보충한다는 비난을 받아 왔는데 이제는 이런식의 시장확대에 제동이 걸리게 되었습니다
투자에 참고하세요




'주식시장이야기' 카테고리의 다른 글
| 미국증시 경기침체 우려에 미 국채금리 하락 지수 반등 성공 (0) | 2022.06.24 |
|---|---|
| 삼성전자 미국시장 파격적인 재고떨이 폴더블스마트폰 ‘갤럭시Z폴드3’ 30만원에 살 수 있다 국내에선? (0) | 2022.06.24 |
| 한미약품 고혈압치료제 아모잘탄 중국 고혈압시장 도전 (0) | 2022.06.23 |
| 검찰 시세조종 혐의 쌍방울그룹 압수수색 중 이재명 변호사비대납의혹 수사(?) (0) | 2022.06.23 |
| 이복현 금융감독원장 금리간섭 안한다 어제 은행장들 모아놓고 뭘 한거야? (0) | 2022.06.23 |












