안녕하세요
삼성제약이 젬백스앤카엘로부터 알츠하이머병 치료제 ‘GV1001’의 국내 임상 개발 및 상업화 권리에 관한 기술을 이전받는 계약을 체결했습니다
본 계약에 따라 젬백스는 삼성제약으로부터 선급금 120억 원과 품목 허가 시 단계별 기술료(마일스톤) 1080억 원을 받게 되는데 매출에 따른 기술 사용료(로열티)는 별도로 지급하고 계약규모는 1,200억원 규모입니다
이번 계약은 국내 권리만 해당하며 한국을 제외한 세계 시장에서 알츠하이머병 치료제 GV1001의 권리는 젬백스가 갖는 조건입니다.
젬백스는 이번 계약을 통해 국내외에서 진행 중인 다양한 임상시험에 소요될 예산을 확보하게 됐고 또 GMP 공장시설을 갖추고 있는 삼성제약에 기술이전 함으로써 3상 임상시험 이후 시판 허가에 따른 생산, 관리, 유통, 마케팅, 영업까지 모두 차질 없이 진행될 수 있는 요건을 갖추게 됐습니다.
삼성제약은 알츠하이머병 치료제로의 가능성을 입증한 GV1001을 주요 임상 파이프라인으로 보유하게 되면서 국내 3상 임상시험의 진행 및 국내에서의 상업화 권리를 가지게 됐습니다.
젬백스 관계자는 “이번 라이선스 계약은 물질 특성에 근거해 알츠하이머라는 새로운 적응증을 발굴하고 실제 임상시험을 통해 치료제로서의 가능성을 입증한 뒤 이뤄진 것이라 더 의미가 크다”며 “향후 젬백스는 알츠하이머병 글로벌 임상시험과 국내 최초의 진행성핵상마비 임상시험에 모든 역량을 집중해 신경퇴행성질환 전반에 걸쳐 성과를 내보이겠다”고 말했습니다.
알츠하이머병 치료제는 노인국가가 빠르게 진행되는 우리나라에서 환자가 급증하고 있는 노인성 질환으로 선진국에서도 알츠하이머병 환자수가 급증하고 있어 글로벌 블록버스터급 신약이 될 수 있는 치료제입니다
삼성제약은 국내 판권을 확보함으로써 임상을 위한 파일롯 생산에 들어가며 임상진행에 가속도를 높이게 되었습니다
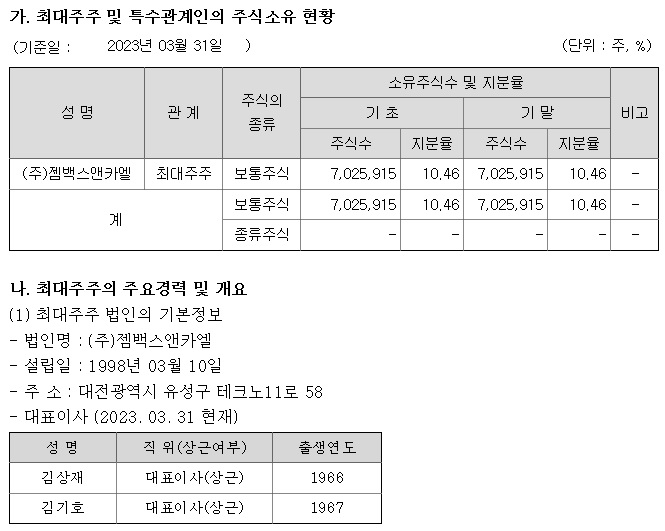
삼성제약은 젬백스의 계열회사이며, 삼성제약의 최대주주는 젬백스로 삼성제약은 젬백스 지분 2.8%를 보유 중에 있습니다
투자에 참고하세요





'주식시장이야기' 카테고리의 다른 글
| 의료기기관련주 글로벌 의료기기업체 M&A 대상으로 관심고조 (0) | 2023.05.28 |
|---|---|
| 상신전자 EMI필터와 전기차용 리액터 생산 페라이트 테마바람 상한가 (0) | 2023.05.28 |
| 삼화전자 테슬라 중국산 희토류 사용중지 페라이트 대체 검토 반사이익기대감 (0) | 2023.05.27 |
| 부동산 시장 가격 반등 기사 6월 까지 팔아치워야 할 악성 매물 바겐세일 중 속은 놈이 하우스푸어 신세 (0) | 2023.05.27 |
| 중국 한한령 다시 강화 중국소비주와 엔터주 게임주 등 일제히 하락세 (0) | 2023.05.27 |







