https://youtu.be/tHIeHuKNvHk?si=zFvcnLCkaOHtErwW

안녕하세요
영국 가디언은 올 1~2월 일본 45개 현에서 ‘독성 쇼크 증후군(STSS)’ 감염이 378건 보고됐다고 지난 15일(현지시간) 전했는데 지난해 일본에서 보고된 STSS사례는 총 941건으로, 감염자 수가 지난해 대비 올 들어 가파른 속도로 늘고 있습니다.
일본 국립감염연구소(NIID)에 따르면 STSS는 'A형 연쇄상구균' 질환으로 전염성이 매우 강한 편으로 감염되면 때에 따라 합병증에 걸리거나 심하면 사망에도 이를 수 있는 심각한 감염병으로 분류되고 있습니다.
보통 감기와 유사한 증세로 나타나지만, 드물게 패혈성 인두염, 편도선염, 폐렴, 뇌수막염 등 합병증이 발생할 수 있고 심한 경우는 장기 부전과 괴사로 이어질 수 있어 치사율이 30%에 달하는 것으로 알려졌습니다.
아사히 신문에 따르면 지난해 7월부터 12월까지 STSS진단을 받은 50세 미만 환자 65명 중 약 3분의 1에 해당하는 21명이 사망한 것으로 나타나 공포감을 주고 있습니다.
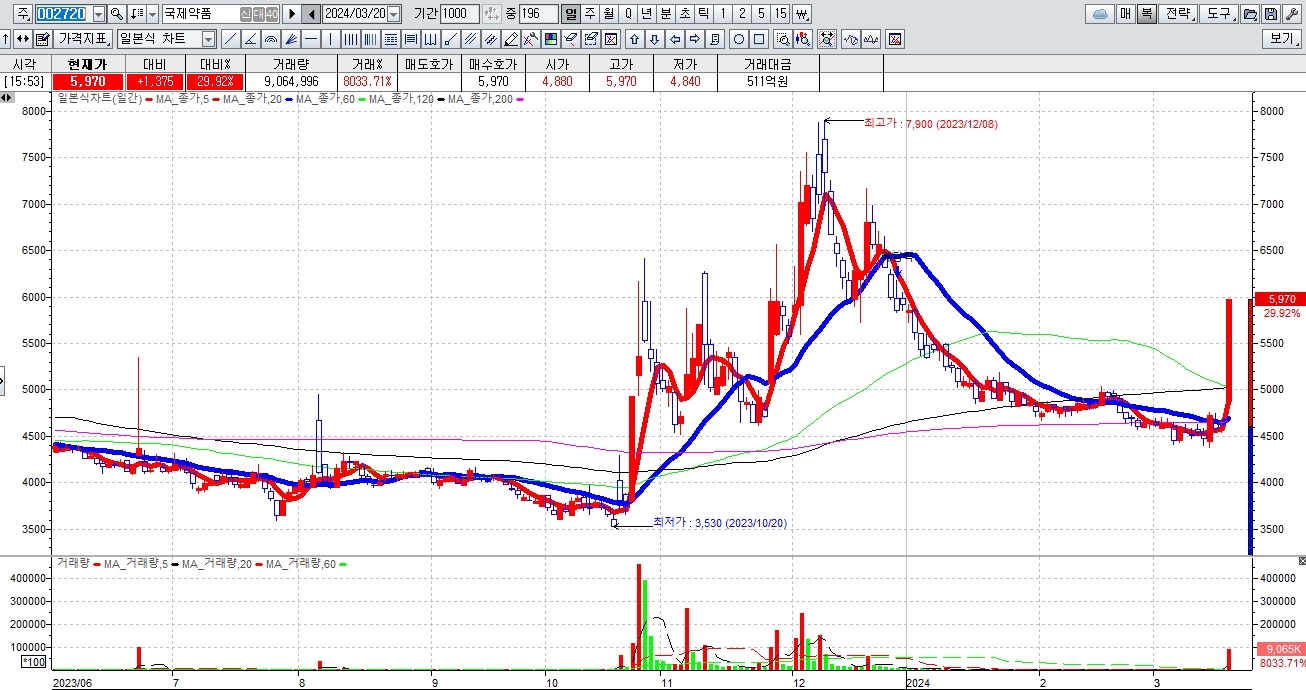
페니실린은 이런 독성쇼크증후군 치료에 주로 사용되는 치료제로 알려져 있어 페니실린 관련주들이 급등하고 있습니다
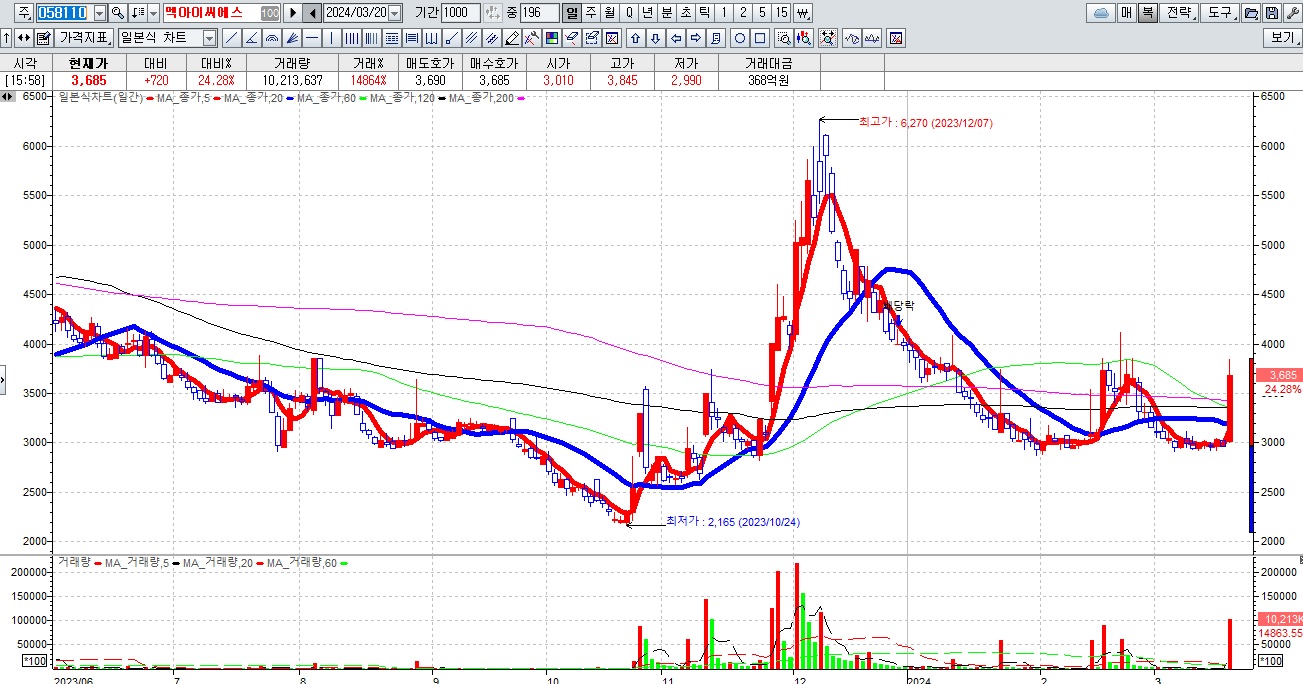
아울러 감염병 진단을 위한 진단관련주들과 맥아이씨에스같은 중환자용 의료기기주들이 급등하고 있는데 의료시스템이 의사정원확대 이슈로 무너지기 직전이라 윤석열 정부에서 의료기기를 대량으로 구매하는 식으로 대응책을 내놓을 것이라는 기대감이 선반영되는 모습입니다
일본 같이 의료시스템이 잘 갖춰진 나라에서도 치사율이 30%에 달하기 때문에 막연한 공포감을 주고 있습니다
특히 우리나라 해외방문국 중 일본이 1위를 차지하고 있어 ‘독성 쇼크 증후군(STSS)’ 감염자의 입국 가능성을 높여주고 있습니다
윤석열 정부와 같이 무능한 정부와 의료계와 의사 증원 문제로 의료시스템이 제대로 작동하지 않을 때 무서운 감염병이 유입되면 대규모 사망자가 발생할 수 있어 주의가 필요해 보입니다
윤석열 정부는 의사 증원 문제를 총선 득표를 위해 이슈화시켜 놓고 해결책을 찾지 못하고 갈등만 증폭시키고 있는데 서울 이외 지역에 의사수 1000명 증원을 알리면서 이들 의과대학에 1000명의 교수를 확충하겠다고 선언해 가뜩이나 의사가 부족하다고 해 놓고 의료교육기관에 1000명이나 의사들을 데려다 쓰면 지방 의료기관에는 더욱 일손이 딸릴 수 있다는 말들이 나오고 있습니다
아울러 사람만 늘려 놓으면 의료교육시설이 열악한 가운데 제대로 교육도 못 시키고 질 떨어지는 의료인들을 양산할 수 있다는 우려가 커지고 있습니다
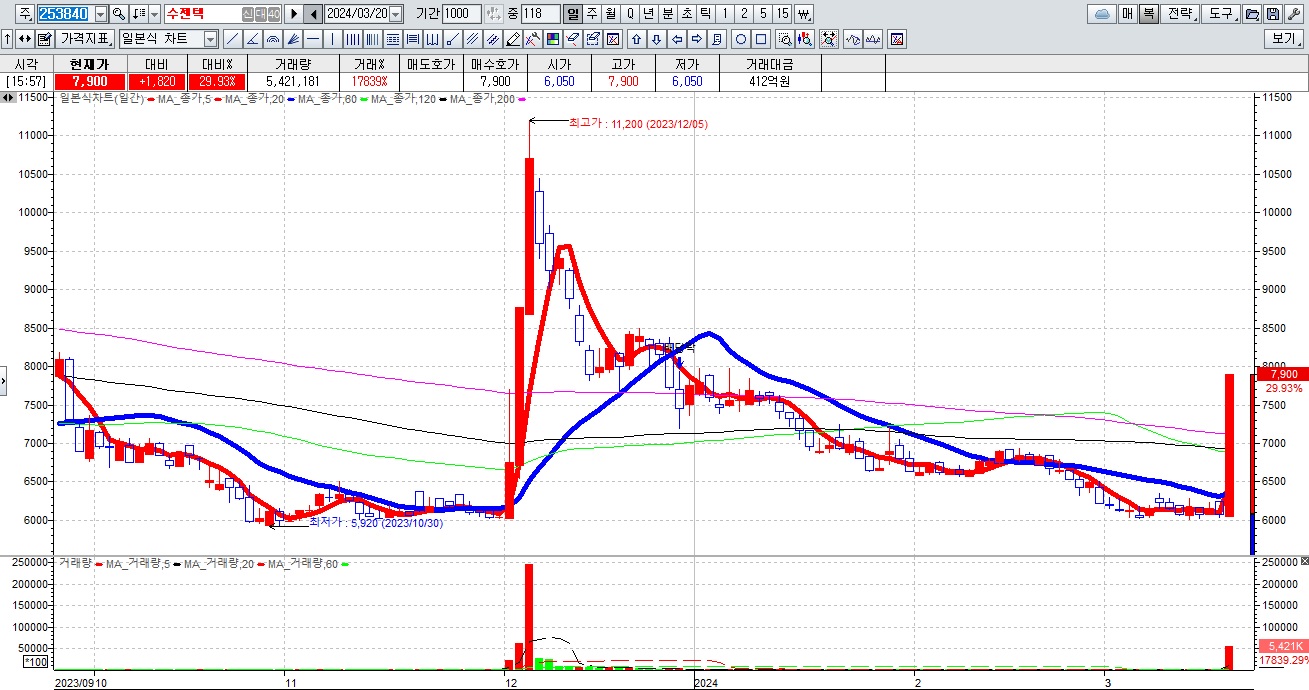
독성쇼크증후군STSS 감염병이 국내에 유입될 경우 대규모 사망자가 발생할 수 있다는 우려에 페니실린과 감염병 진단 관련주들이 대거 강세를 나타내고 있습니다
투자에 참고하세요
독성쇼크증후군STSS 감염병 관련주
국제약품
광동제약
신풍제약
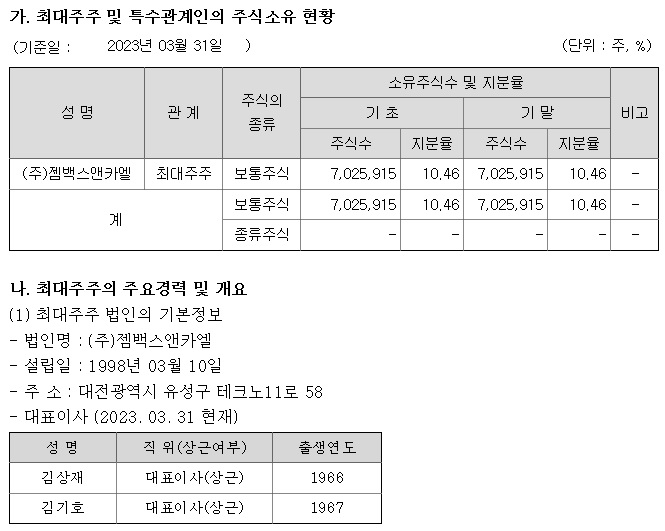
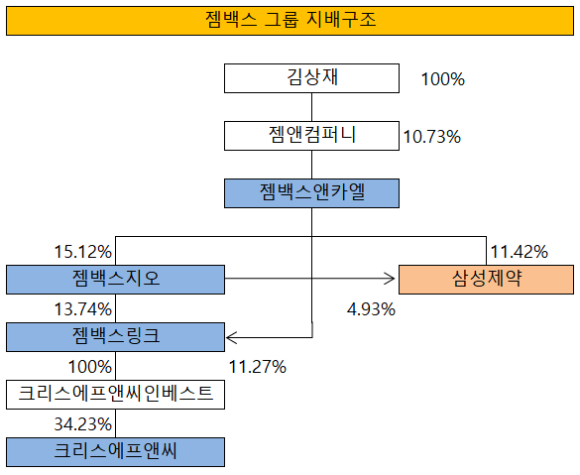
삼성제약
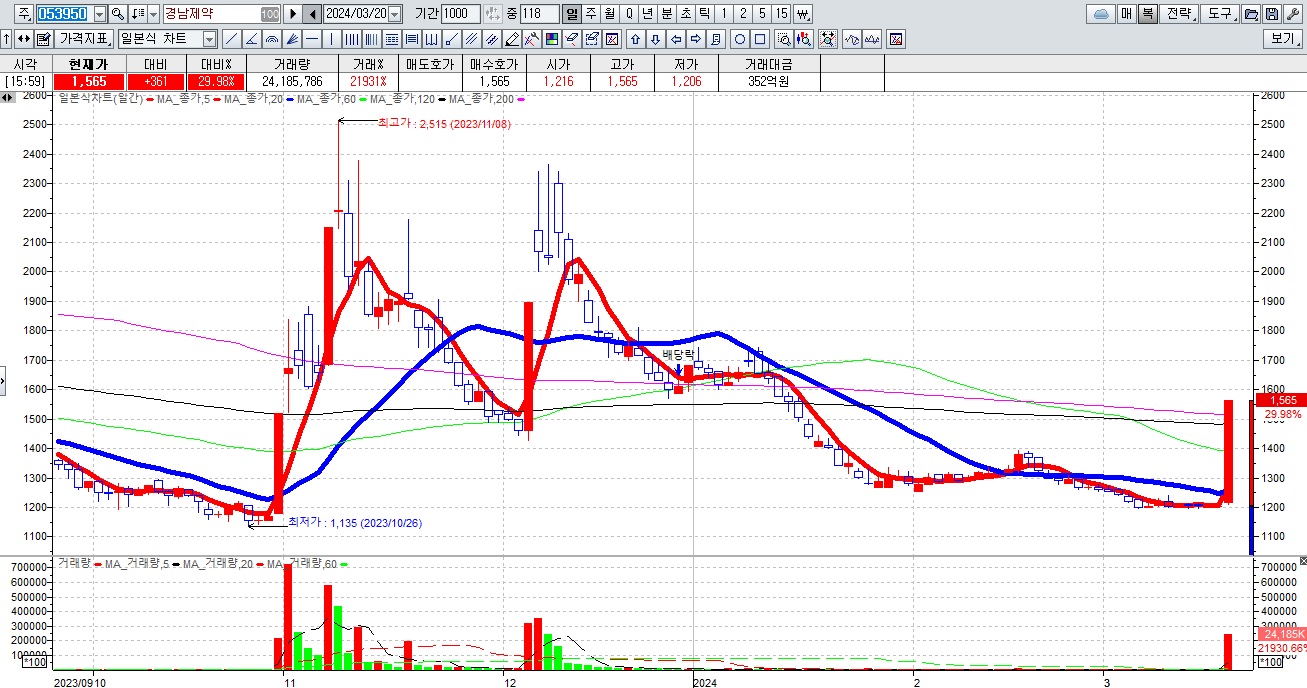
경남제약
명문제약
일성신약
영진약품
위더스제약
수젠텍
진시스템
진매트릭스
소마젠
엑세스바이오
아이큐어
바디텍메드


'주식시장이야기' 카테고리의 다른 글
| 미 연준 기준금리동결 올 해 금리인하 3회 유지 일제히 사자 (1) | 2024.03.21 |
|---|---|
| 태영건설 외부감사인 삼정회계법인 의견거절 상장폐지 가능성 (0) | 2024.03.21 |
| 12월 결산법인 3월 정기주총 감사보고서 미제출 기업 주가급락세 투자주의보 (2) | 2024.03.20 |
| HB인베스트먼트 총 310억원 규모 ‘에이치비 디지털혁신성장 3호 투자조합’ 결성 (0) | 2024.03.20 |
| 자율주행관련주 텔레칩스 미국 레이더업체 '오라(AURA)'에 대규모 투자와 현대차그룹 5조원 R&D투자소식에 일제히 강세 (0) | 2024.03.20 |