
안녕하세요
메디포스트가 개발한 주사형 무릎 골관절염 치료제가 국내 2상 임상에 돌입합니다.
27일 업계에 따르면 메디포스트는 차세대 주사형 무릎 골관절염 치료제 SMUP-IA-01의 국내 2상 임상시험계획(IND)가 식품의약품안전처로부터 승인 받았습니다.
SMUP-IA-01의 주성분인 스멉셀(SMUP Cell)은 메디포스트가 독자적으로 개발한 차세대 줄기세포 플랫폼 기술로 생산된 고효능의 동종 제대혈유래 중간엽줄기세포로 SMUP-IA-01은 치료 효능이 뛰어날 뿐 아니라 바이오리액터를 통해 대량 생산을 할 수 있어 생산 시간 및 원가 절감이 가능하고 또한 냉동제형으로 보관 및 유통 문제를 해소해, 그동안 1세대 세포치료제가 지녔던 상업화와 글로벌시장 진출의 어려움을 극복했다는 평가를 받고 있습니다.
이번 국내 임상 2상은 경증 및 중등증(K&L 2~3등급)의 무릎 골관절염 환자 총 90명을 대상으로 무릎 관절강 내에 SMUP-IA-01을 1회 주사 투약한 후, 1년간의 관찰기간을 통해 안전성과 탐색적 유효성을 평가하고 임상 3상을 위한 최적의 용량도 확인할 계획인데 이번 임상시험은 서울대학교병원, 신촌 세브란스병원 및 분당 서울대학교병원 총 3개 기관에서 진행됩니다.
메디포스트 관계자는 "SMUP-IA-01은 약물 치료로 효과를 보지 못하거나 수술에 망설일 수 있는 치료 공백을 겪는 환자들이 선택할 수 있는 대안이 될 것으로 기대한다"고 말했습니다.
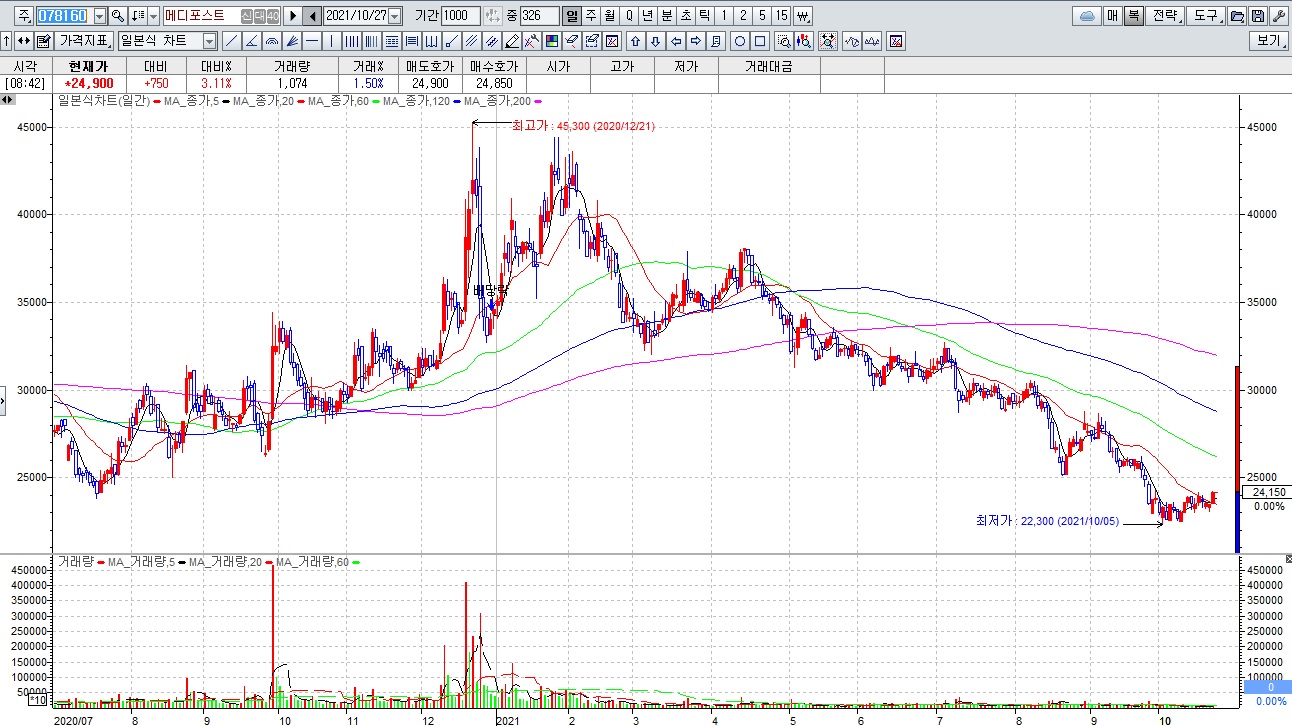
메디포스트 주가가 흘러내리고 있는 것은 제대혈 시장의 경쟁이 치열해 지면서 수익성에 빨간불이 들어온 때문인데 적자를 지속하고 있지만 신약 개발에 연구비가 계속 들어가고 있어 재무구조가 점점 부정적으로 바뀌고 있기 때문입니다
주사형 무릎 골관절염 치료제 스멉셀(SMUP Cell)도 2020년 사업이 지연되고 있는 것으로 파이프라인들의 연구진척이 확인되어야 주가 회복도 지속될 수 있는 상황입니다
최대주주 지분이 적어 함부로 유상증자를 할 수도 없는 상황이라 주가 상승을 견인하고 이후 유상증자를 할 가능성이 커 보입니다
투자에 참고하세요


'주식시장이야기' 카테고리의 다른 글
| 카카오페이 기업공개(IPO) 공모주 청약 MZ세대 성황 (0) | 2021.10.27 |
|---|---|
| 버킷스튜디오 오징어게임 주인공 베우 이정재 미국 고담 어워즈 연기상 후보 소식에 상한가 (0) | 2021.10.27 |
| 삼성SDI와 미국 완성차 기업 스텔란티스 미국 전기차배터리 공장 합작 건설 전략적 협력 방침 재확인 (0) | 2021.10.27 |
| 제넨셀 관련주 경구용 코로나19치료제 식약처 임상 IND 승인 소식에 관심 고조 (0) | 2021.10.27 |
| 국제유가 되살아난 수요 대비 부족한 공급으로 2014년 이후 최고치 기록 (0) | 2021.10.27 |




























