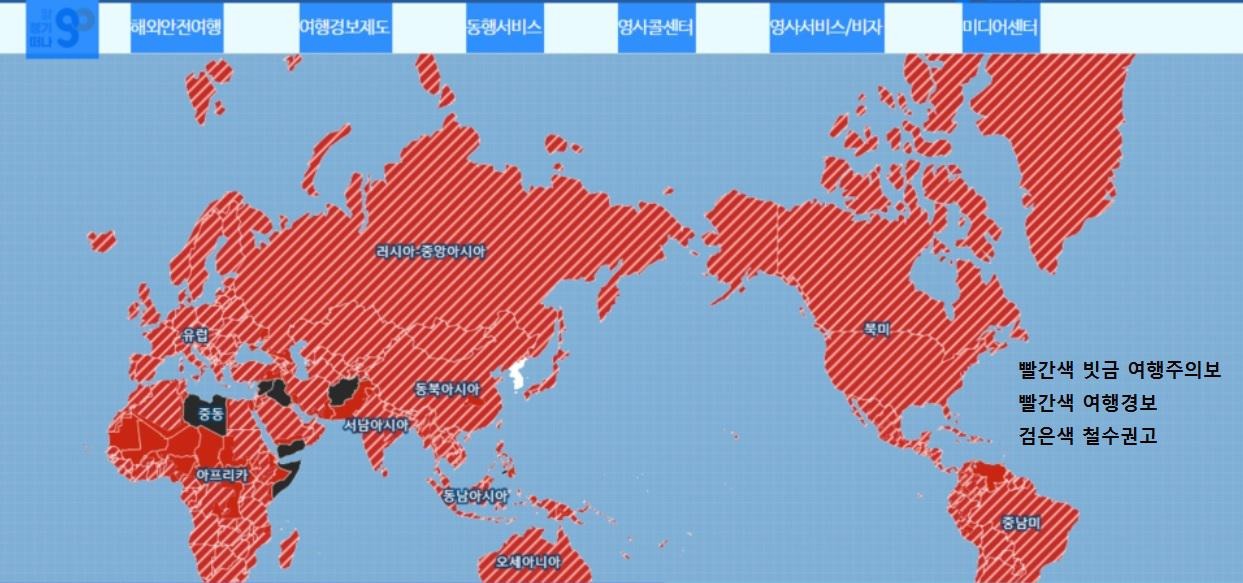
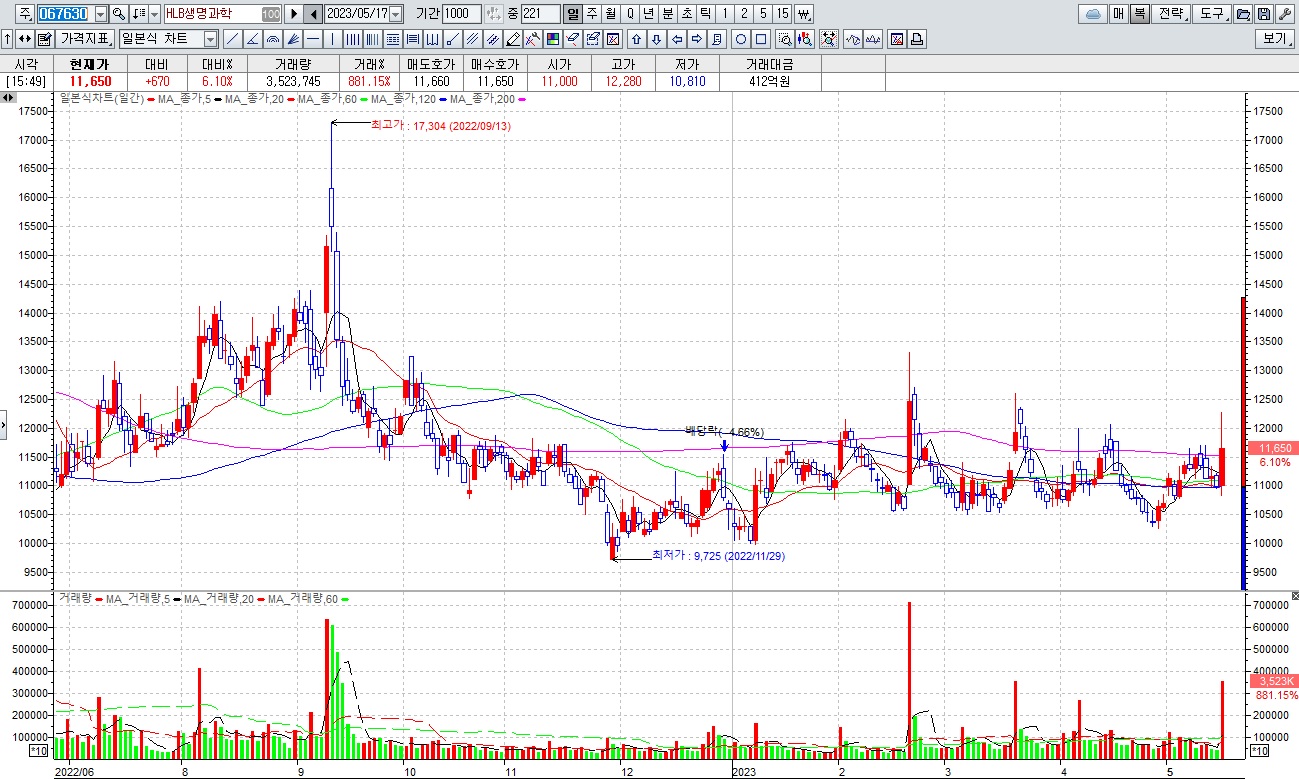
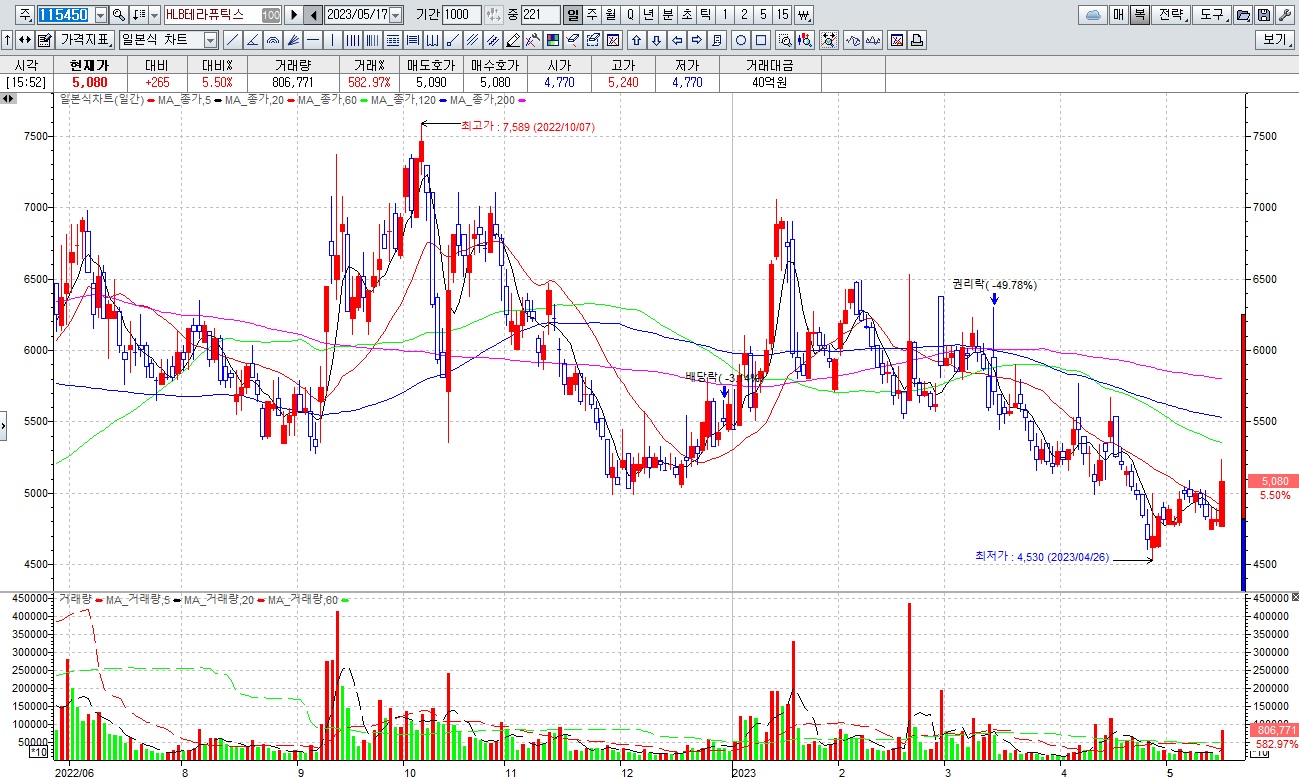
HLB그룹주 미국 식품의약국(FDA)에 간암 1차 치료제로 ‘리보세라닙(rivoceranib)’ 신약허가신청서(NDA) 제출 소식에 일제히 급등세
주식시장이야기 2023. 5. 17. 16:32안녕하세요
HLB는 17일 미국 식품의약국(FDA)에 간암 1차 치료제로 ‘리보세라닙(rivoceranib)’의 신약허가신청서(NDA)를 제출했다고 밝혔는데 이번 NDA 신청은 중국 항서제약의 PD-1 항체 ‘캄렐리주맙(camrelizumab)’과의 병용요법으로 항서측과 함께 진행해왔으며, 항서제약은 미국 FDA에 캄렐리주맙의 바이오의약품허가신청서(BLA)를 제출합니다.
이번 FDA 허가신청은 HLB가 리보세라닙의 첫 글로벌 임상을 시작한 지난 2011년 이후 12년만의 성과라고 회사측은 의미를 부여했습니다.
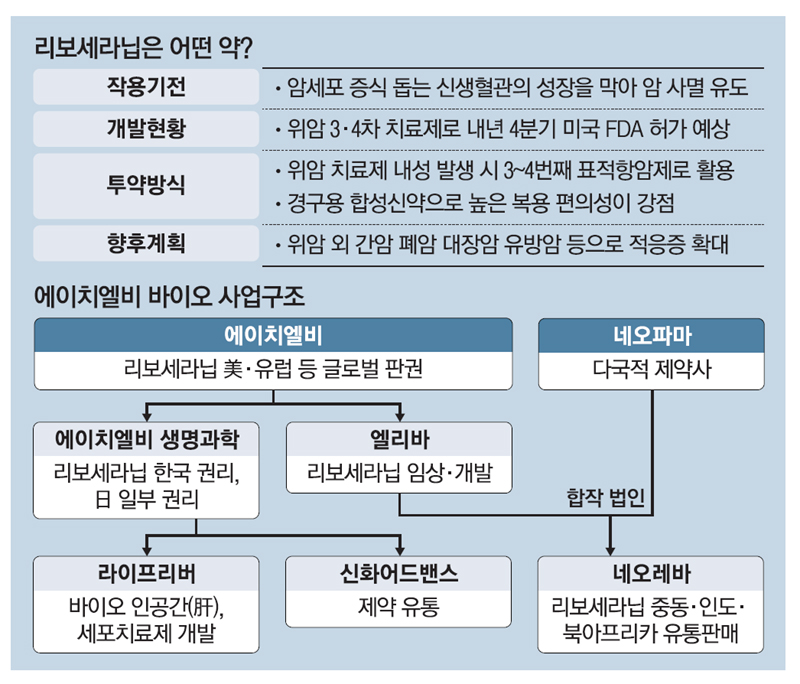
리보세라닙의 글로벌 특허권리를 보유한 HLB는 미국 자회사 엘레바 테라퓨틱스(Elevar Therapeutics)를 통해 리보세라닙과 중국 항서의 면역관문억제제 캄렐리주맙과의 병용요법을 간암 1차 치료제로 개발해왔습니다.
회사에 따르면 ‘리보세라닙+캄렐리주맙’ 병용요법은 13개국 543명의 환자를 대상으로 진행한 임상3상에서 전체생존기간 중앙값(mOS) 22.1개월(vs 15.2개월), 무진행생존기간 중앙값(mPFS) 5.6개월(vs 3.7개월), 전체반응률(ORR) 25.4%(vs 5.9%), 질병통제율(DCR) 78.3%(vs 53.9%), 반응지속기간(DoR) 14.8개월(vs 9.2개월) 등 대조군인 넥사바(Nexava, sorafenib) 대비 통계적으로 유의미한 개선을 보였다(p<0.0001). 이는 지역(아시아 vs 非아시아)과 발병원인(바이러스성 vs 非바이러스성)에 상관없었다고 주장하고 있습니다.
‘리보세라닙+캄렐리주맙’ 병용요법은 지난 2월 중국에서 간암 1차치료제로 승인받았습니다.
정세호 엘레바 대표는 “이번 NDA 제출은 전세계 간암 환자들에게 더 나은 치료옵션을 제공하고자 노력해온 결과로 신약허가를 받을 수 있을 것으로 기대한다”고 말했습니다.
리보세라닙은 혈관내피 성장인자 수용체(VEGFR-2)를 억제해 암의 성장에 필수적인 산소와 영양분의 공급을 차단, 암을 효과적으로 사멸하는 TKI 계열 경구용 약물입니다.
현재까지 신생혈관억제 기전의 TKI 항암제와 면역항암제의 병용요법으로 허가된 간암 1차치료제가 없다고 엘레바측은 설명했는데 엘레바는 신약허가와 상업화를 동시에 진행하는 ‘투트랙’ 전략으로 신약허가 후 빠른 판매가 이뤄질 수 있도록 미국 내 상업화 준비에도 착수했다고 밝혔습니다.
김동건 HLB 대표는 “새로운 치료옵션을 기다리고 있는 간암 환자와 가족들, 그리고 오랜 신약개발 여정을 함께해 온 임직원들이 자부심을 느낄 수 있도록 남은 절차에도 최선을 다하겠다”고 말했습니다.
한편 리보세라닙은 HLB가 글로벌 특허권을 보유하고 있으며, HLB생명과학이 한국 판권과 유럽·일본에 대한 일부 수익권을, 항서제약이 중국 판권을 가지고 있고 이외 지역에 대한 글로벌 판권은 엘레바가 갖고 있습니다.
리보세라닙의 병용요법으로 미국 FDA에서 신약허가신청서(NDA)가 승인이 나도 얼마나 수익을 낼 수 있을 지는 의문이 드는데 희귀의약품 정도라면 글로벌 시장에서도 그렇게 큰 수익을 내기는 어렵지 않나 생각됩니다
병용요법이라 사용법의 제한도 있어 의사들의 처방이 많이 나올 수 있을 지 의문이 입니다
투자에 참고하세요



'주식시장이야기' 카테고리의 다른 글
| 미국증시 연방정부 부채한도 협상 긍정 기대감에 일제히 급반등세 (0) | 2023.05.18 |
|---|---|
| 한국산업은행 7.5억 유로화 공모채권 발행 성공 외국인투자자 일제히 순매수 전환 (0) | 2023.05.17 |
| 엑스게이트 SK텔레콤과 양자보안기술 VPN 출시 상한가 (0) | 2023.05.17 |
| 메타바이오메드 1분기 실적발표 어닝서프라이즈 미중패권전쟁 어부지리 (0) | 2023.05.17 |
| 이녹스첨단소재 LG디스플레이와 삼성전자의 OLED 동맹 수혜 기대감 (0) | 2023.05.17 |